Klinisk sirkulasjonsfysiologi - Institutt for sirkulasjon og bildediagnostikk
Klinisk sirkulasjonsfysiologi
Aktuell forskning
Sirkulasjonen drives av hydraulisk energi levert i pulser. Effektiviteten av energileveransen avhenger av den ventrikuloarterielle koblingen, samspillet mellom hjertets kontraktilitet og karsengens motstand mot blodstrøm. Den totale arterielle motstanden, vaskulær impedans, utgjøres både av statiske og dynamiske elementer; den avhenger både av aortas og de store karenes elastisitet, perifer motstand i små arteriegreiner, reflekterte trykkbølger, blodets viskositet og hjertefrekvensen. Den vaskulære impedansen kan endres betydelig av sykdom eller medisiner. Et misforhold i samspillet mellom hjertet og karsengen kan redusere energi-leveransen og den kardiovaskulære effektiviteten dramatisk.
Klinisk overvåking av kardiovaskulær funksjon hos kritisk syke er i dag oftest basert på øyeblikks tallverdier for blodtrykk og blodstrøm. Dermed bruker man kun en brøkdel av all den informasjonen som ligger i de kontinuerlige, pulsatile kurvene for blodtrykk og blodstrøm. Dette gjør at viktig informasjon om pulsatiliteten og den perifere regulering av sirkulasjonen, som i fysiologiske dyrestudier har vist seg å ha stor betydning, faller bort.
Vår forskningsgruppe har i samarbeid med ultralydmiljøet ved NTNU utviklet software for helt samtidig måling av kontinuerlig blodtrykk og ultralydmålt blodstrøm. Systemet, kalt Ultra Power (uPWR - ultralydbasert Cardiac Power), gir flere muligheter:
- Multiplikasjon av blodtrykkskurven med kurven for blodstrøm ut av venstre ventrikkel gir en effektkurve (Cardiac Power) som beskriver mengden hydraulisk energi som overføres til sirkulasjonen per tidsenhet.
- Kalkulasjon av andelen av denne energien som er knyttet til pulsasjonene i blodtrykk og blodstrøm (Oscillatory Power) er et mål for dynamisk ventrikuloarteriell kobling
- Impedansanalyser som indikerer om endringer i impedansen har opphav sentralt eller perifert i sirkulasjonssystemet.
Dette nye verktøyet åpner for spennende klinisk forskning, utvikling av nye kliniske monitorerings-modaliteter og etablering av nye behandlingsmål hos kritisk syke. Så langt har Cardiac Power-prosjektet gitt opphav til to ph.d.-prosjekt:
- Audun Eskeland Rimehaug: «Beat-to-beat cardiac power – minimally invasive assessment of overall cardiovascular performance” (avsluttet, Rimehaug disputerte 02.12.2016)
- Tomas Dybos Tannvik: “Ultrapower, from experimental physiology to patient monitoring. The exploration of a novel Doppler based assessment of human cardiovascular function” (pågår).
Det er imidlertid rom for ytterligere rekker av enkeltstudier og / eller ph.d.-prosjekt.
Septisk sirkulasjonssvikt skyldes i hovedsak tre forhold; dilatasjon av motstandsregulerende kar på arteriesiden, økt kapillær-permeabilitet med væskelekkasje fra blodbanen, og septisk kardiomyopati med senket kardial kontraktilitet. I klinisk medisin overvåkes sirkulasjonen ofte ved måling av blodtrykk, men ved alvorlig sirkulasjonssvikt er forholdet mellom blodtrykk og vevsperfusjon variabelt og uforutsigbart. I slike situasjoner brukes ofte blodstrømsmålinger i tillegg for å sikre organperfusjonen, men behandling av sirkulasjonssvikt basert på slik overvåking med bruk av f.eks. pulmonalarteriekateter har ikke vist seg å endre mortalitet eller lengde på intensiv- eller sykehusopphold.
Vi deltar i et større samarbeidsprosjekt, kalt Sepcease, med professor Hans Torp ved Ultralydgruppen ved Institutt for sirkulasjon og bildediagnostikk ved NTNU og professorene Erik Solligård og Jan Kristian Damås, Midt-Norsk senter for sepsisforskning. Planene for dette prosjektet er dels å bruke nyutviklet ultralydteknologi for å se på septiske endringer i perifer/ miro-sirkulasjon, dels å bruke vårt ultra-power verktøy (se nærmere beskrivelse av det under «Ultra Power») for å studere om sepsis påvirker energioverføringen fra hjertet til sirkulasjonen. Kombinasjonen av disse to tilnærmingene kan også gi muligheter for å studere sammenhengen mellom makro- og mikro-sirkulasjon ved sepsis.
Sepcease-prosjektet fokuserer både på mulighetene for tidligere deteksjon av sepsis og for bedret monitorering av etablert sepsis. Siden sepsis er en heterogen tilstand, vil vi se etter mønstre som kan brukes til å klassifisere pasientene og individualisere behandlingen. Likedan vil vi studere effekten av terapeutiske intervensjonene for å se om de nye verktøyene kan brukes til å optimalisere behandlingen.
Svekket regulering av nyregjennomblødningen er et tidlig tegn på akutt nyresvikt, men er vanskelig å måle klinisk siden nyrene beveges med pusten. Vi bruker maskinlæring for å måle nyreblodstrøm uavhengig av pustebevegelsene.
Bakgrunn
Akutt nyresvikt er en fryktet komplikasjon ved store operasjoner og alvorlig sykdom. Den både forlenger sykeleiet og øker dødeligheten. Fordi nyrene har stor reservekapasitet oppdages nyresvikten seint. Undersøkelse av autoreguleringen av nyrens blodstrøm gir tidligere diagnose og kan bidra til redusert sykelighet og død. Dette krever imidlertid lengre registrering av nyreblodstrømmen enn hva som er mulig med konvensjonell ultralyd.
Metode
Utvikling av dype lærings algoritmer for automatisk segmentering og tracking av nyrearterier for ultralydopptak av blodstrømsdata av flere minutters varighet. Estimering av blodstrømshastigheter med flere ulike metoder, samt kombinering av blodtrykks- og blodstrømsdata.
Status og fremdrift
Prosjektet befinner seg i en teknisk utviklingsfase. Nyetablerte algoritmer og metoder må valideres ved datasimulering, testing i modeller og forsøksdyr. Parallelt med dette starter vi innsamling av et større datamateriale fra pasienter med sikte på videreutvikling og optimalisering av metodene.
Resultater
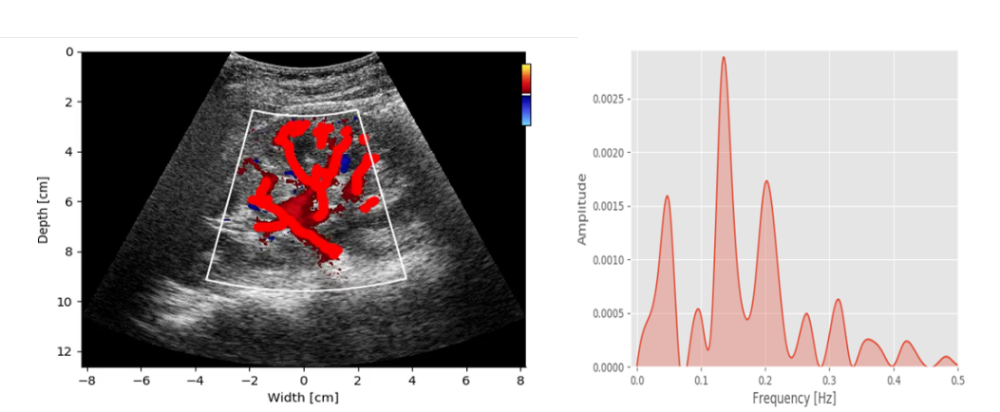
Vi har lyktes med å definere en bevegelig «Region of interest» for innhenting av blodstrømsdata og metoder for akvisisjon av komplekse hastighetsssignal fra denne.
Gevinster
Maskinlæring kan gi robuste målinger av blodstrømshastigheter over lengre tid enn det som er mulig med konvensjonell ultralyd. Dermed kan utvikling av en klinisk anvendbar metode for undersøkelse av autoreguleringen av nyrens blodstrøm være mulig.
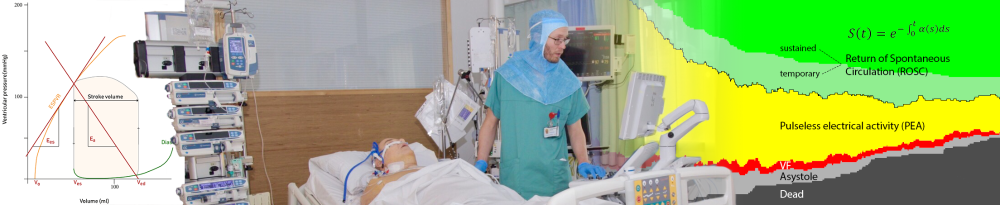
Hvert år gjøres det forsøk på gjenoppliving hos ca. 2500 personer utenfor sykehus i Norge, og (trolig) hos ca. 1500 pasienter innlagt på norske sykehus. Når hjertet stanser helt opp skyldes dette enten sykdom i hjertet (for eksempel hjerteinfarkt) eller ytre faktorer (for eksempel drukning). Tiden er avgjørende, og umiddelbare tiltak i de første minuttene (HLR, defibrillering, medikamenter) er avgjørende for prognosen. Vår gruppe har – i nært samarbeid med medisinske og tekniske forskere i Norge og i utlandet – undersøkt den dynamiske utviklingen under pågående HLR, fasen som avgjør om pasienten dør eller får tilbake stabil egensirkulasjon.
Ved å bruke moderne statistiske metoder for levetidsanalyse, såkalte multi-state modeller, har vi beskrevet forløpet under HLR (f or eksempel sannsynligheten for at pasienten får tilbake egensirkulasjonen eller «mister» egensirkulasjonen når den først er gjenvunnet). Videre undersøker vi hvilke faktorer som påvirker dette forløpet (for eksempel hjertestansens årsak), og hvordan pasientens EKG endrer seg underveis.
Arbeidet har så langt gitt opphav til en rekke publikasjoner og fire PhD-prosjekter:
- Trond Nordseth (2014): «Clinical state transitions during the provision of advanced life support (ALS) to patients in cardiac arrest»
- Daniel Bergum (2016): «In-hospital cardiac arrest - causes, recognition and survival»
- Gunnar Waage Skjeflo (2019): «PEA development in cardiac arrest»
- Anders Norvik (pågår): “Adrenalin ved resuscitering fra Pulsløs elektrisk aktivitet (PEA)»
Vi har særlig satt søkelyset på pulsløs elektrisk aktivitet (PEA) som første rytme, da dette rammer mange pasienter og er dårlig undersøkt; og på hjertestans på sykehus fordi muligheten for observasjoner av det dynamiske forløpet er best når akuttpersonell er raskt tilstede.
Vi vil arbeide videre med analyse av hvilken umiddelbar effekt medikamentet adrenalin har under forløpet, og tilsvarende analyser av hjertestans og resuscitering av barn.
Her finner du pasientinformasjon om hjertestans og gjenopplivning.
Hypotermi hos traumepasienter og utfall hos hodeskadepasienter med tidlig temperaturavvik
Bakgrunn
Avvikende kjernetemperatur (vanligvis hypotermi) forekommer hyppig hos skadde pasienter og er assosiert med økt dødelighet. Når i forløpet traumepasienter blir kalde har ikke vært fullstendig kartlagt.
En betydelig del av dødsfall etter traumer skyldes hodeskade. Terapeutisk hypotermi brukes for å begrense skade ved nevrokirurgi, men det er ikke fullstendig kartlagt hvordan tidlig aksidentelt avvik fra normal kjernetemperatur påvirker utfallet hos pasienter med hodeskade.
Metode
I første del av prosjektet fulgte vi traumepasienter fra skadested, gjennom evakuering og akuttmottak/traume-CT og til intensiv/operasjon for å identifisere når i forløpet de ble nedkjølt.
I andre del av prosjektet henter vi nå ut temperaturdata retrospektivt fra traumejournal hos pasienter som har blitt innlagt på St Olavs hospital med moderat eller alvorlig hodeskade.
Status og fremdrift
Første del av prosjektet er avsluttet der 22 pasienter ble inkludert. Nå befinner prosjektet seg i en datainnsamlingsfase igjen der tidlige temperaturer hos i overkant av 800 pasienter som allerede er inkludert i Hodeskaderegisteret ved St Olavs skal hentes ut.
Resultater
Vi har lyktes med å finne ut at traumepasienter blir kalde allerede på skadestedet med et snitt i tap 1,6°C/time. Gjennomsnittstid fra ulykkestidspunkt og til start evakuering var 55 minutter, mens median transporttid var 30 minutter. For optimal behandling bør temperaturen måles prehospitalt og tiltak mot ytterligere nedkjøling bør iverksettes, herunder aktiv oppvarming under transport. Forskerlinjeoppgaven «When do trauma patients get cold?» - Pre- and in-hospital body temperature developement in the trauma patient, ble ferdigstilt i 2015.
Fremover vil vi se på hvor vanlig det er med tidlig avvik i kroppstemperatur hos pasienter med moderat/alvorlig hodeskade og hvilke konsekvenser dette potensielt har på utkomme hos denne pasientgruppen spesielt.

Kritisk sykdom og/eller stor kirurgi innebærer ofte sirkulasjonssvikt. Dette er en stor utfordring, både fordi sirkulasjonssvikt er alvorlig, men også fordi instrumentene vi har til å overvåke sirkulasjonen har en del begrensninger.
Én måte å overvåke sirkulasjonen på er å bruke ultralyd fra spiserøret for å overvåke hjertet, men dette krever konstant tilstedeværelse av lege og er dermed upraktisk. Vi er i ferd med å utvikle et system som innebærer fortløpende automatiske ultralydopptak med umiddelbar dataanalyse hos pasienter med sirkulasjonssvikt.
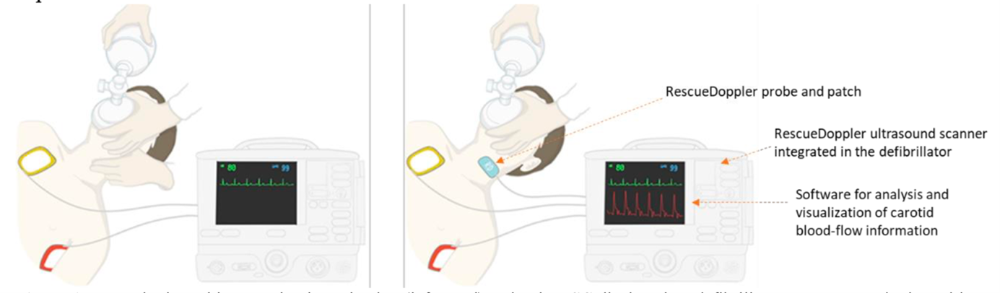
Prosjektet har som mål å utvikle RescueDoppler - en ultralydsmetode basert på kontinuerlig Doppler av blodstrømmen i a. carotis ved hjertestans.
Manuell pulspalpering er i dag gullstandarden for å oppdage tilstedeværelse eller fravær av blodstrøm ved hjertestans, men har alvorlige begrensninger og er verken en rask eller pålitelig metode. I en studie kunne 45 % av helsepersonell ikke oppdage sentral puls under hjertestans nøyaktig. Manglende følbar puls er ikke ensbetydende med sirkulasjonsstans. Hvis sirkulasjonen allerede er gjenopprettet, er brystkompresjoner unødvendig og kan gjøre mer skade enn nytte. Det er derfor behov for et brukervennlig verktøy for å vurdere blodstrømmen ved hjertestans.
Ny ultralydteknologi utviklet av professor Hans Torp har ført til en metode for måling av kontinuerlig blodstrøm under hjerte- og lungeredning, RescueDoppler. Proben festes på pasientens hals som et plaster og registrerer blodstrøm kontinuerlig, med potensial om å bedre diagnostisering, behandling og resultat ved hjertestans.
Dopplermålinger av blodstrøm i a. carotis kan utføres uten å avbryte gjenopplivning, noe som gjør det til et attraktivt alternativ for hemodynamisk veiledet og personlig tilpasset behandling.
RescueDoppler-systemet inkluderer en liten og lett ultralydprobe, en ultralydskanner og programvare for signalanalyse. Teknologien er operatøruavhengig og krever ikke ultralydekspertise.
Automatiserte eksterne defibrillatorer kan diagnostisere livstruende hjertearytmier ved å tolke EKG, slik at utrente lekfolk eller tilskuere kan bruke dem. Selv om defibrillatorer kan oppdage, behandle og gi tilbakemelding på etablering av normal hjerterytme, mangler avgjørende tilbakemeldinger om vellykket gjenoppretting av sirkulasjonen (ROSC). RescueDoppler har potensiale til å gi informasjon om ROSC.
RescueDoppler prosjektet består av fire delprosjekt:
- Dyreeksperiment
- Maskinlæring (kunstig intelligens) før å definere ROSC
- Teknisk utvikling av probe, probesystem og festemekanisme
- Klinisk multisenter studie
Dyreeksperiment
På ANILAB på Nord Universitet i Bodø utføres dyreeksperimentene på gris. Vi har utviklet en hypotensjonsmodell og en hjertestansmodell. Hypotensjonsmodellen viser at RescueDoppler godt samsvarer med invasivt blodtrykk fra a. carotis. I hjertestansmodellen utløses ventrikkel flimmer via en ICD som er lagt in i apeks i høyre ventrikkel. Ventrikkel flimmer sjokkes tilbake til sinusrytme via ICD. Hensikten med dyreeksperimentet er å vise om RescueDoppler kan si noe om kvaliteten av kompresjoner i tillegg til informasjon om ROSC.
Klinisk pilot- og multisenter studie
Pilotstudie blir lokalisert til prehospital klinikk, Nordlandssykehuset i Bodø og in-hospitalt på St Olavs hospital hvor RescueDoppler blir brukt på flest mulig hjertestanser. Deretter, under et års tid, skal RescueDoppler brukes på flest mulige hjertestanser på 8 forskjellige sykehus (St Olavs Hospital, Akershus Universitetssykehus, Oslo Universitetssykehus Ullevål, Oslo Universitetssykehus Rikshospitalet, Stavanger Universitetssykehus, Nordlandssykehuset Bodø, Sahlgrenska Universitetssykehus, Aarhus Universitetssykehus).
RescueDoppler forskningsgruppen
Eksperimentell forskningsgruppe
Charlotte Ingul (prosjektleder, professor ISB, NTNU, professor Nord Universitet), Bjørn Faldaas (ph.d.-student, Nord Universitet), Erik Waage Nielsen (professor, UiT, Nord Universitet, Benjamin Storm (ph.d.-student, Nord Universitet), Eirik Skogvoll (professor, ISB, NTNU), Knut Tore Lappegård (professor UiT), Gabriel Kiss (første amanuensis, Institutt for datateknologi og informatikk), Ole Jacob How (professor UiT).
Klinisk forskningsgruppe:
Charlotte Ingul (prosjektleder, professor ISB, NTNU, professor Nord Universitet), Eirik Skogvoll (professor, ISB, NTNU), Hans Torp (professor, ISB, NTNU), UiO),) Torbjørn Hergum (PhD, Cimon Medical AS), Guro Mæhlum Krüger (PhD-student, ISB), Gabriel Kiss (første amanuensis, Institutt for datateknologi og informatikk), Morten Sildnes Andersen (masterstudent, NTNU), Sunniva Gjerald Birkeli (forskningssykepleier, St. Olavs hospital), Hedda Juni Lund (prosjektkoordinator).


